成纤维细胞生长因子受体(FGFR)在多种恶性肿瘤中存在异常激活,并与肿瘤的发生发展密切相关,已成为目前“不限癌种”的热点研究靶标之一。目前国外已有靶向FGFR的抑制剂上市,用于胆管癌、尿路上皮癌等适应症。佩米替尼作为国内首款获批上市的FGFR抑制剂,填补了国内胆管癌靶向治疗的空白,也开启了胆管癌精准靶向治疗新纪元。
作为肿瘤精准治疗的基础,基因检测同样是关注度极高的话题。那么如何能精准找到FGFR突变的患者?这一靶点如何进行检测?检测有何难点?本文将详细解读。
01
FGFR2融合主要发生在肝内胆管癌,明确分子诊断是精准医学的新需求
胆管癌是一种恶性程度高且进展迅速的疾病,目前唯一有效的治愈方法是根治性手术。然而,大多数患者(约65%)在被诊断时已处于晚期,错过了手术切除的机会。即使进行手术切除,5年生存率仅约为20%~35%[1]。
不可切除或复发转移的胆管癌患者应选择系统治疗。根据ABC-02研究数据,一线标准化疗方案吉西他滨联合顺铂(GC)的中位生存期为11.7个月,无进展生存期为8个月。根据ABC-06研究数据,二线化疗方案FOLFOX在之前接受过GC治疗的患者中的中位生存期仅为6.2个月[1]。换句话说,目前胆管癌的二线及以后治疗方案疗效有限。
在肿瘤分子生物学的发展中,靶向治疗受到了广泛关注。其中,FGFR是胆管癌治疗的重要靶点。类似于表皮生长因子受体(EGFR),FGFR也属于人类基因组中酪氨酸受体激酶(TRK)家族。人类基因组中存在着4种FGFR受体和12种配体,在调节细胞生长、发育、成熟和凋亡过程中发挥重要作用。异常的FGFR信号激活可驱动肿瘤发生、促进肿瘤血管生成和耐药[3]。
目前,国内外正在开发多种针对FGFR的小分子抑制剂和抗体类药物,其中FGFR抑制剂pemigatinib(佩米替尼)已于2022年4月在中国获批上市,作为国内唯一获批的FGFR2抑制剂,佩米替尼二线治疗胆管癌的mPFS可达9.1个月,mOS可达23.9个月[2]。
对于胆管癌患者来说,检测FGFR2基因融合突变的状态是指导靶向药物治疗的前提。这对于提高患者的生存率、延长生存期并提高生活质量具有重要意义。FGFR2基因融合主要发生在肝内胆管癌(iCCA)(图1)[5],因此,在进行FGFR2融合/重排检测时,应优先考虑iCCA患者。
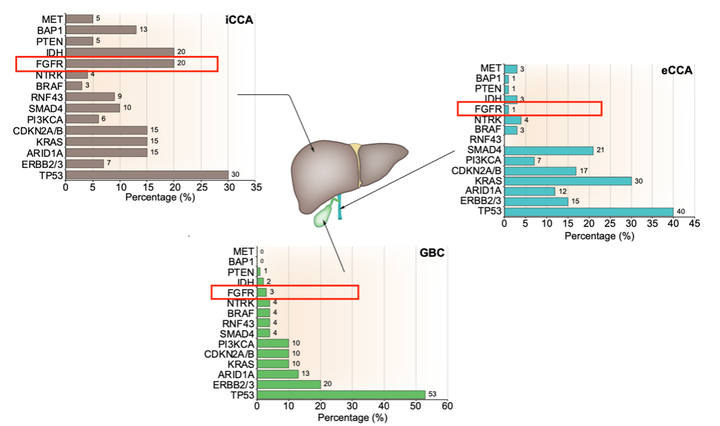
图1. FGFR2融合主要发生在肝内胆管癌(iCCA)
2022年最新的《中国肝内胆管癌病理专家共识》[6]明确指出,病理分型是胆管癌病理诊断和治疗的基础,应重视检测iCCA靶向和免疫治疗生物标志物,为临床制定靶向抑制剂治疗方案提供参考依据。
02
“长尾效应”突出,FGFR2融合/重排只检测常见“热点”变异会导致大量漏检
基因融合是由不同染色体的重排所引起的,这些融合可能涉及易位、倒位和缺失等染色体结构变化。FGFR2最常见的融合伴侣基因是BICC1,此外还有CIT、CCDC6、CCAR2、OFD、AHCYL1、PPHLN1等多种伴侣基因。
根据FIGHT-202研究对107例FGFR2融合/重排患者的特征分析,其中92例为融合,15例为重排,共涉及56种伴侣基因。其中,最常见的伴侣基因是BICC1(31/107,占29%),有42种伴侣基因仅在1例患者中出现(42/107,占39%)。
从以上研究结果可以看出,FGFR2融合的热点不够集中,而是呈现出分布广泛的"长尾"现象。因此,仅仅检测常见的"热点"融合变异可能会导致大量阳性患者被遗漏。理想的检测技术应该能够检测已知和未知的融合变异。
03
权威指南推荐,FISH和NGS可有效检出FGFR的已知和未知融合变异
目前用于检测融合基因的方法主要包括:荧光原位杂交(FISH)、实时荧光PCR(RT-PCR)、免疫组织化学(IHC)、以及二代测序(NGS),不同的检测方法各有优势和不足(图2)。
FISH和NGS可以有效检出FGFR的已知和未知融合变异,PCR只能检测已知变异,会造成大量假阴性,另外,因为野生型和FGFR2融合阳性样本中FGFR2蛋白表达水平相当,IHC在胆管癌中不是可行的CDx方法,因此IHC检测特异性差,会造成大量假阳性结果。
图
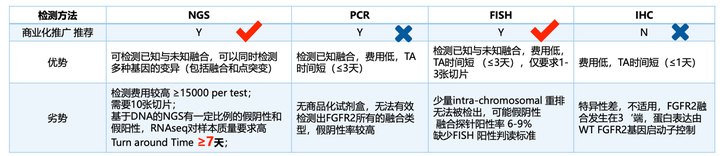
2. 不同检测方法的优劣势比较
CSCO[7]、肝内胆管癌病理诊断专家共识(2022版) [6]、ESMO[8]等国内外权威指南均推荐对胆管癌FGFR2融合行FISH或NGS检测(图3)。那么,FISH和NGS如何进行选择呢?

图3. 肝内胆管癌病理诊断专家共识(2022 版)关于FGFR融合/重排检测的推荐
为了解决FGFR检测的可及性问题,需要同时推进两种不同的检测方法,以充分发挥各自的优势。FISH检测具有操作简便、快速检测、样本需求少和价格较低等优点,更适合在医院内作为常规检测方法,减轻患者的经济负担,并满足临床快速决策的需求;而NGS技术可以检测多个基因,但需要较大样本量、检测时间较长且价格相对较高,而且大多数基因缺乏相应的治疗药物和手段,因此可以根据患者的实际情况选择适当的方法。
FISH技术属于成熟的检测技术,在国际市场上已有获得欧洲IVD资质的FGFR2 FISH探针。国内也已有成熟的检测产品,FGFR2重排探针已获得一类备案凭证,但FISH判读标准仍需要规范化。
总之,通过检测FGFR2融合突变的状态,我们可以指导选择适当的靶向药物治疗方案,提高胆管癌患者的生存率并延长生存期。FGFR检测已成为现代精准医学的重要内容,为个体化治疗提供了新的选择。尽管选择合适的检测方法仍面临一定的挑战,但通过共同推进FISH和NGS等技术的发展,将能够解决FGFR检测的可及性问题,为患者提供更精确、快速的诊断和治疗决策,为胆管癌患者带来希望并改善生存质量。
参考文献
Queiroz MM, et al. Immunotherapy and Targeted Therapy for Advanced Biliary Tract Cancer: Adding New Flavors to the Pizza. Cancers (Basel). 2023;15(7):1970.
Shi G, et al. Pemigatinib in Chinese patients with advanced/metastatic orsurgically unresectable cholangiocarcinoma Including FGFR2fusion or rearrangement: Updated overall survival from an openlabel, single-arm, multicenter Phase II study. 2023 AACR: Abstract CT153.
Touat M, et al. Targeting FGFR Signaling in Cancer. Clin Cancer Res. 2015;21(12):2684-2694.
Helsten T, et al. The FGFR Landscape in Cancer: Analysis of 4,853 Tumors by Next-Generation Sequencing. Clin Cancer Res. 2016;22(1):259-267.
Lamarca A, et al. Molecular targeted therapies: Ready for "prime time" in biliary tract cancer. J Hepatol. 2020;73(1):170-185.
《肝内胆管癌病理诊断专家共识(2022版)》编写专家委员会等. 肝内胆管癌病理诊断专家共识(2022版). 中华病理学杂志. 2022;51(9):819-827.
中国临床肿瘤学会指南工作委员会. CSCO 胆道恶性肿瘤诊疗指南. 2023.
Mosele F, et al. Recommendations for the use of next-generation sequencing (NGS) for patients with metastatic cancers: a report from the ESMO Precision Medicine Working Group. Ann Oncol. 2020;31(11):1491-1505.